國家藥監(jiān)局發(fā)文:醫(yī)用透明質(zhì)酸鈉產(chǎn)品類別將調(diào)整
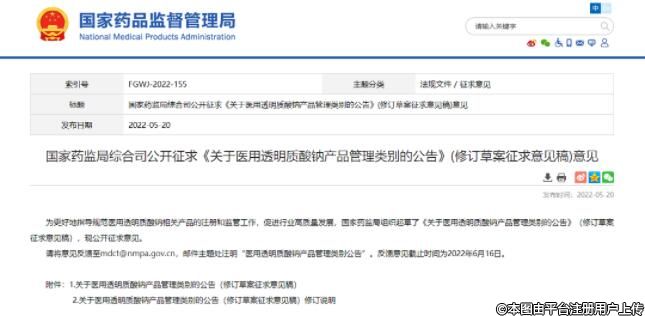
為更好地指導規(guī)范醫(yī)用透明質(zhì)酸鈉相關產(chǎn)品的注冊和監(jiān)管工作,促進行業(yè)高質(zhì)量發(fā)展,國家藥監(jiān)局組織起草了《關于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告》(修訂草案征求意見稿),現(xiàn)公開征求意見。
附件1
關于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告(修訂草案征求意見稿)
為加強以透明質(zhì)酸鈉(玻璃酸鈉)為主要成分的醫(yī)療產(chǎn)品的監(jiān)督管理,進一步規(guī)范相關產(chǎn)品注冊(備案),保證公眾用藥用械用妝安全有效,根據(jù)《藥品管理法》《醫(yī)療器械監(jiān)督管理條例》和《化妝品監(jiān)督管理條例》相關規(guī)定,現(xiàn)對該類產(chǎn)品管理有關事宜公告如下:
一、根據(jù)不同預期用途(適應癥)、工作原理等,醫(yī)用透明質(zhì)酸鈉(玻璃酸鈉)產(chǎn)品按照以下情形分別管理:
(一)用于治療關節(jié)炎、干眼癥等的產(chǎn)品,按照藥品管理。
(二)符合以下情形,且不含發(fā)揮藥理學、代謝學或免疫學作用的藥物成分時,按照醫(yī)療器械管理,其管理類別不得低于第二類。
1、作為體腔器械(不含避孕套)導入潤滑劑應用時,按照第二類醫(yī)療器械管理。
2、作為口腔潰瘍、口腔組織創(chuàng)面愈合治療輔助材料應用時,按照第二類醫(yī)療器械管理。
3、作為接觸鏡護理產(chǎn)品應用時,按照第三類醫(yī)療器械管理。
4、作為可吸收外科防粘連材料應用時,按照第三類醫(yī)療器械管理。
5、作為眼用粘彈劑應用時,按照第三類醫(yī)療器械管理。
6、作為注射填充增加組織容積產(chǎn)品應用時,按照第三類醫(yī)療器械管理。
7、作為注射到真皮層,主要通過所含透明質(zhì)酸鈉的保濕、補水等作用,改善皮膚狀態(tài)應用時,按照第三類醫(yī)療器械管理。
8、用于修復膀胱上皮氨基葡萄糖保護層應用時,按照第三類醫(yī)療器械管理。
9、作為醫(yī)用敷料應用時,若產(chǎn)品可部分或者全部被人體吸收,或者用于慢性創(chuàng)面,按照第三類醫(yī)療器械管理;若產(chǎn)品不可被人體吸收且用于非慢性創(chuàng)面,按照第二類醫(yī)療器械管理。
10、作為輔助改善皮膚病理性疤痕,輔助預防皮膚病理性疤痕形成的疤痕敷料應用時,按照第二類醫(yī)療器械管理。
11、作為同一單包裝中避孕套的潤滑劑,應當與避孕套一同注冊,按照第二類醫(yī)療器械管理。?
(三)對于含有透明質(zhì)酸鈉(玻璃酸鈉)的藥械組合產(chǎn)品,應當根據(jù)產(chǎn)品首要作用方式判定為以藥品作用為主或者以醫(yī)療器械作用為主的藥械組合產(chǎn)品。其中,含有抗菌成分的醫(yī)用敷料產(chǎn)品、含有藥物的整形用注射填充物等按下述原則判定:
1、含有抗菌成分的醫(yī)用敷料產(chǎn)品,應當提供非臨床藥效學研究和/或臨床研究證實產(chǎn)品是否具有抗菌作用。
(1)如果非臨床藥效學研究和/或臨床研究顯示產(chǎn)品具有明確的抗菌作用,其中,主要通過抗菌作用實現(xiàn)其預期用途的產(chǎn)品判定為以藥品為主的藥械組合產(chǎn)品;主要通過創(chuàng)面物理覆蓋、滲液吸收等作用實現(xiàn)其預期用途的產(chǎn)品判定為以醫(yī)療器械為主的藥械組合產(chǎn)品。
(2)如果非臨床藥效學研究和/或臨床研究未顯示產(chǎn)品具有抗菌作用,則產(chǎn)品按照醫(yī)療器械管理。用于判定產(chǎn)品是否具有抗菌作用的非臨床藥效學研究和/或臨床研究及評判標準可參考藥品研發(fā)相關的非臨床和臨床技術指導原則。?
2、含有局麻藥等藥物(如鹽酸利多卡因、氨基酸、維生素)、主要通過填充增加組織容積的整形用注射填充物,判定為以醫(yī)療器械為主的藥械組合產(chǎn)品。
3、含有局麻藥等藥物(如鹽酸利多卡因、氨基酸、維生素等)、主要通過所含透明質(zhì)酸鈉的保濕、補水等作用,改善皮膚狀態(tài)的醫(yī)療美容用注射材料,判定為以醫(yī)療器械為主的藥械組合產(chǎn)品。
4、含有藥物的體腔器械(不含避孕套)導入潤滑劑,判定為以醫(yī)療器械為主的藥械組合產(chǎn)品。
(四)以涂擦、噴灑或者其他類似方法,施用于皮膚等人體表面,以清潔、保護、修飾、美化為目的的日用化學工業(yè)產(chǎn)品,按照化妝品管理。
(五)用于緩解陰道干燥的產(chǎn)品(不包括用于陰道創(chuàng)面護理的產(chǎn)品),不按照藥品、醫(yī)療器械或者化妝品管理。
二、自公告發(fā)布之日起,按照上述管理類別受理醫(yī)用透明質(zhì)酸鈉(玻璃酸鈉)產(chǎn)品的注冊申請。
三、已經(jīng)按照藥品或醫(yī)療器械受理的注冊申請,正在審評、審批的品種,繼續(xù)按照藥品或醫(yī)療器械進行審評、審批,符合要求的,核發(fā)藥品批準文號或醫(yī)療器械注冊證書。其中,需要改變管理屬性或類別的,限定其批準文號或注冊證書的有效期截止日期為2024年12月31日。
四、已獲得藥品批準文號或醫(yī)療器械注冊證的產(chǎn)品,需要改變管理屬性、管理類別的,原藥品批準文號或醫(yī)療器械注冊證在證書有效期內(nèi)繼續(xù)有效;所涉及企業(yè)應當按照相應管理屬性和類別的有關要求積極開展轉換工作,在2024年12月31日之前完成轉換。開展轉換工作期間原藥品批準文號或醫(yī)療器械注冊證到期的,在產(chǎn)品安全有效且上市后未發(fā)生嚴重不良事件或質(zhì)量事故的前提下,企業(yè)可按原管理屬性和類別向原審批部門提出延期申請,予以延期的,原藥品批準文號或醫(yī)療器械注冊證有效期不得超過2024年12月31日。
五、已按第一類醫(yī)療器械備案的冷敷凝膠、光子冷凝膠、液體敷料、膏狀敷料等產(chǎn)品,按照《關于實施〈第一類醫(yī)療器械產(chǎn)品目錄〉有關事項的通告》(國家藥監(jiān)局通告2021年第107號)和《關于調(diào)整〈醫(yī)療器械分類目錄〉部分內(nèi)容的公告》(國家藥監(jiān)局公告2022年第25號)有關要求執(zhí)行。
六、相關生產(chǎn)企業(yè)應當切實落實產(chǎn)品質(zhì)量安全主體責任,確保上市產(chǎn)品的安全有效。各級藥品監(jiān)督管理部門要加強宣貫培訓,切實做好相關產(chǎn)品審評審批和上市后監(jiān)管工作。
七、本公告自發(fā)布之日起實施,《關于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告》(原國家食品藥品監(jiān)督管理局公告2009年第81號)同時廢止。
附件2
《關于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告》
(修訂草案征求意見稿)修訂說明
一、修訂背景
2009年,原國家食品藥品監(jiān)督管理局發(fā)布《關于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告》(2009年第81號,以下簡稱81號公告),指導規(guī)范醫(yī)用透明質(zhì)酸鈉(玻璃酸鈉)相關產(chǎn)品的的注冊和監(jiān)管工作。隨著科技和產(chǎn)業(yè)的快速發(fā)展,新產(chǎn)品不斷涌現(xiàn),81號公告已不能完全滿足行業(yè)和監(jiān)管需要。因此,國家藥監(jiān)局組織開展了81號公告修訂工作。
二、修訂過程
依據(jù)《藥品管理法》《醫(yī)療器械監(jiān)督管理條例》《化妝品監(jiān)督管理條例》,以及《醫(yī)療器械分類規(guī)則》《醫(yī)療器械分類目錄》《關于藥械組合產(chǎn)品注冊有關事宜的通告》等,梳理國內(nèi)外透明質(zhì)酸鈉(玻璃酸鈉)醫(yī)療器械注冊產(chǎn)品現(xiàn)狀及國內(nèi)外關于透明質(zhì)酸鈉(玻璃酸鈉)產(chǎn)品分類管理政策,根據(jù)透明質(zhì)酸鈉(玻璃酸鈉)的技術特點和產(chǎn)品風險程度,總結了醫(yī)用透明質(zhì)酸鈉類產(chǎn)品分類界定有關原則,并組織醫(yī)療器械分類技術委員會專業(yè)組專家研究,進一步修改完善,形成修訂草案征求意見稿。
三、修訂內(nèi)容和需要說明的問題
(一)目前透明質(zhì)酸鈉(玻璃酸鈉)產(chǎn)品除了在藥品、醫(yī)療器械應用外,還常用于化妝品、食品等領域,部分產(chǎn)品用途介于藥品、醫(yī)療器械、化妝品邊緣。為更好地指導相關產(chǎn)品管理屬性和類別判定,修訂稿中增加了涉及透明質(zhì)酸鈉(玻璃酸鈉)的邊緣產(chǎn)品、藥械組合產(chǎn)品管理屬性界定原則以及相關醫(yī)療器械產(chǎn)品分類原則,明確了相關產(chǎn)品的管理屬性和管理類別。
(二)用于治療膀胱上皮氨基葡萄糖保護層缺損的醫(yī)用透明質(zhì)酸鈉產(chǎn)品,已按照第三類醫(yī)療器械批準上市。該類產(chǎn)品目前無按照藥品批準上市的情形,為保持管理的延續(xù)性,繼續(xù)維持原管理屬性。
(三)當醫(yī)用透明質(zhì)酸鈉產(chǎn)品用于注射進入皮膚真皮層及以下時,應當根據(jù)產(chǎn)品的組成、預期用途和實現(xiàn)預期用途的工作原理綜合判定:(1)通過填充增加組織容積的產(chǎn)品,已列入《醫(yī)療器械分類目錄》13-09-02整形用注射填充物,按第三類醫(yī)療器械管理。(2)但當此類產(chǎn)品含有局麻藥等藥物(如鹽酸利多卡因、氨基酸、維生素)時,主要通過填充增加組織容積實現(xiàn)其預期用途,判定為以醫(yī)療器械為主的藥械組合產(chǎn)品,按醫(yī)療器械申報注冊。
(四)對于注射進入皮膚真皮層,通過透明質(zhì)酸鈉(玻璃酸鈉)的保濕、補水作用,用于改善皮膚狀態(tài)的醫(yī)療美容用注射材料,考慮到用于填充增加組織容積的透明質(zhì)酸鈉已列入《醫(yī)療器械分類目錄》13-09-02整形用注射填充物,按照第三類醫(yī)療器械管理,二者使用形式和風險類似;經(jīng)專家討論,建議將該類產(chǎn)品也納入醫(yī)療器械管理。因此在修訂稿中明確了該類產(chǎn)品的屬性和分類界定原則。
(五)81號公告中規(guī)定“用于治療……皮膚潰瘍等具有確定的藥理作用的產(chǎn)品,按照藥品管理”,但隨著科技的發(fā)展和對透明質(zhì)酸鈉認識的加深,目前科研界普遍認為當透明質(zhì)酸鈉用在醫(yī)用敷料中時,其作用原理主要為物理作用。因此,考慮該類產(chǎn)品管理屬性和管理類別根據(jù)組成、預期用途和是否可吸收等綜合判定。
(六)透明質(zhì)酸鈉作為一種保濕補水成分,已在化妝品中應用。以涂擦、噴灑或者其他類似方法,施用于皮膚等人體表面,以保護、美化為目的的含透明質(zhì)酸鈉產(chǎn)品,按照化妝品管理。該類產(chǎn)品不應當宣稱醫(yī)療用途。
(七)鑒于輔助改善皮膚病理性疤痕,輔助預防皮膚病理性疤痕形成的疤痕修復材料已列入《醫(yī)療器械分類目錄》14-12-02疤痕修復材料,按照第二類醫(yī)療器械管理。此類產(chǎn)品含有透明質(zhì)酸鈉時,其管理屬性和管理類別不作改變。
(八)透明質(zhì)酸鈉(玻璃酸鈉)一般從動物組織提取或通過微生物發(fā)酵法生產(chǎn),存在一定的潛在風險,第一類醫(yī)療器械監(jiān)管措施難以保障其安全有效性,因此按照醫(yī)療器械管理的醫(yī)用透明質(zhì)酸鈉(玻璃酸鈉)產(chǎn)品的管理類別應當不低于第二類。
(九)為明確實施要求,規(guī)定了不同情形下注冊申請有關事項,對涉及產(chǎn)品管理屬性或類別轉換的情形,給予了約2年的實施過渡期,以保證平穩(wěn)過渡。
文章內(nèi)容來源:國家藥品監(jiān)督管理局
免責說明:本文由網(wǎng)友自由發(fā)布,如有侵權,請聯(lián)系本網(wǎng)站進行刪除